Que hay más viudas que viudos es algo bien sabido por todos. En España, por ejemplo, solo hay que consultar el Instituto Nacional de Estadística (INE) para corroborar que la esperanza de vida de las mujeres en nuestro país continúa siendo superior a la de los hombres. Los últimos datos disponibles indican que la esperanza de vida de las personas nacidas en España en 2021 era de 80,24 años para los hombres y de hasta 85,83 para las mujeres. Una diferencia de algo más de cinco años.
Si observamos los datos disponibles en el INE desde 1975 descubriremos que la esperanza de vida al nacimiento ha ido creciendo con el paso de los años, a la par que han progresado la calidad de vida, la dieta y la asistencia médica. En 1975 la esperanza de vida de las mujeres al nacer era de 76,25 años (casi diez años menos que en 2021), mientras que la de los hombres era de 70,53 años (también diez años menos que ahora). Sin embargo la diferencia de alrededor de cinco años entre hombres y mujeres se ha mantenido. Sorprendente.
Está claro, con los datos encima de la mesa, que los hombres vivimos menos que las mujeres. Por eso hay más viudas que viudos. Ahora bien, ¿cómo explicamos esta diferencia?
Más viudas, pero no por el riesgo laboral
Antaño se recurrió a explicaciones manidas, y seguramente erróneas, relativas a los supuestos esfuerzos en la jornada laboral que realizaban (algunos) hombres frente a la supuesta ausencia de esfuerzos en la jornada laboral de la mayoría de las mujeres. De lo que se llegaba a deducir que los hombres afrontaban más peligros que las mujeres y de ahí que acabaran muriendo antes. Pero aquella no parecía una explicación razonable.
La búsqueda siguió apuntando a las diferencias cromosómicas. Los hombres tienen un cromosoma X y un cromosoma Y (XY), mientras que las mujeres tienen dos cromosomas X (XX), aunque en cada célula deben inactivar uno de los dos cromosomas X para mantener la viabilidad celular. Pues bien, hubo investigaciones que sugerían que tener dos copias de un mismo cromosoma resultaba, a la larga, más eficaz que tener dos copias diferentes para los cromosomas sexuales.
Este efecto protector no solo aparecía en la especie humana, sino que el estudio australiano lo confirmaba en nada menos que 229 especies animales. En promedio, el sexo homogamético (XX) vivía un 17.6 % más que el heterogamético (XY).
Sin embargo, el descubrimiento seguía sin explicar por qué los individuos XY viven menos, cinco años menos para la especie humana. ¿Será por una mayor propensión de los hombres a ser afectados por enfermedades infecciosas frente a las mujeres, cuyo sistema inmunitario estaría más preparado para luchar contra esas infecciones, como proponen algunos? Esta y otras especulaciones sin base científica han proliferado los últimos años.
El cromosoma Y perdido
Más allá de las especulaciones, existe la observación científica, la recopilación de datos para su análisis. De ahí parte un reciente estudio publicado en la revista Science en el que se señala a la pérdida del cromosoma Y por parte de algunas células de la sangre como la razón de que los hombres vivan menos que las mujeres.
Al parecer, en hombres (XY) la pérdida espontánea del cromosoma Y es relativamente frecuente en células hematopoyéticas, las células de la sangre, como los linfocitos. Técnicamente esa pérdida se conoce como mLOY (mosaic loss of Y chromosome), la pérdida mosaico del cromosoma Y. Se llama mosaico porque no ocurre en todas las células de la sangre. Este mLOY se detecta en el 40 % de los hombres de 70 años y en el 57 % de hombres de 93 años.
La pérdida del cromosoma Y se asocia a peores pronósticos en cánceres de la sangre y a una menor esperanza de vida. También a una mayor probabilidad de desarrollo de tumores sólidos, alzhéimer, alteraciones cardíacas y enfermedades cardiovasculares.
Sin embargo todo esto son solo correlaciones descriptivas, y ya sabemos que una correlación no indica causalidad. Nada indica de forma inequívoca que la causa de todas estas patología sea la pérdida del cromosoma Y. Hay que hacer experimentos. Y eso es lo que hizo un equipo de investigadores de un consorcio japonés, sueco y norteamericano al eliminar el cromosoma Y de las células de la sangre en ratones con CRISPR-Cas9.
El experimento se explica fácilmente en dos pasos. Emplearon una estrategia CRISPR-Cas9 en ratones usando guías ARN complementarias a las secuencias repetidas que hay alrededor del centrómero del cromosoma Y. Así favorecieron la pérdida del cromosoma Y en ciertas células de la sangre, aprovechando las células madre hematopoyéticas de un ratón que expresaba constantemente la nucleasa Cas9.
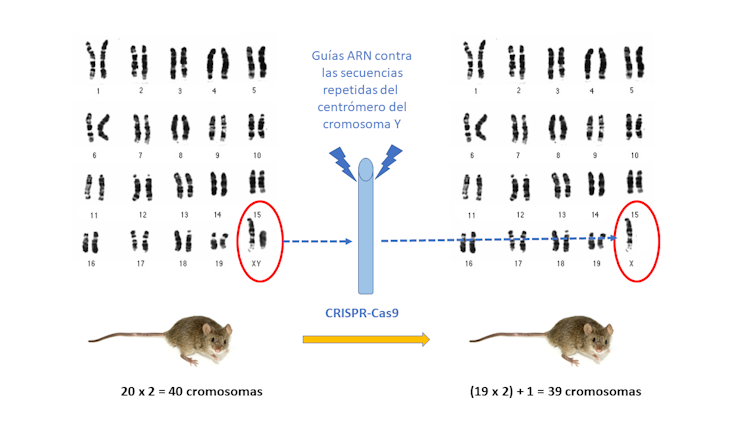
Luego, estas células las transfectaron con lentivirus portadores de las guías ARN y marcadores fluorescentes para verificar el proceso. Y finalmente, trasplantaron las células que habían perdido el cromosoma Y con eficiencias muy altas (80 al 95%) a la médula ósea de ratones irradiados a los que se les había eliminado sus propias células madre hematopoyéticas.
A partir de ese momento, los ratones sí mostraron similitudes con lo que ocurre en seres humanos, en los hombres. Para empezar, perdieron el cromosoma Y en los linfocitos circulantes mosaicos, entre el 49 y el 81 % de las células, con valores similares a los detectados en hombres de edad avanzada. Y estos valores los mantuvieron los ratones editados con CRISPR durante más de 12 meses.
¿Tenía consecuencias ese cromosoma de menos? Sin duda, sí. Entre otras cosas, vivían menos que los ratones con el cromosoma Y intacto. También desarrollaban cardiomiopatías con mayor frecuencia, con un ligero pero significativo incremento del tamaño del corazón, que no se correlacionaba con un incremento de peso corporal. Además, aumentó la fibrosis en el miocardio de estos ratones editados y disminuía la presión sanguínea.
La fibrosis también se observaba en los pulmones y los riñones de los ratones cuyos genes habían sido editados genéticamente, junto con una pérdida de memoria significativa. Todos ellos eran síntomas previamente descritos en pacientes en los que se detectaba la pérdida del cromosoma Y en un número significativo de sus linfocitos.
La aplicación del método científico había permitido comprobar que la eliminación experimental del cromosoma Y en células hematopoyéticas acortaba la esperanza de vida de los ratones y conducía a la aparición de síntomas de alteraciones cardiovasculares. Exactamente igual que en los hombres de edad avanzada.
El trabajo publicado en Science contiene muchas más revelaciones. Por ejemplo, que si se comprime experimentalmente la aorta de los ratones editados con CRISPR y sin cromosoma Y en sus células sanguíneas, aumenta la infiltración de macrófagos del sistema inmunitario. Eso hace que proliferen los fibroblastos (fibrosis), lo que a la larga produce fallo cardíaco. La buena noticia es que tratando a estos ratones con un anticuerpo monoclonal anti-TGFbeta (una citoquina) se puede revertir esta fibrosis. Por lo tanto, podría servir como tratamiento para los hombres de edad avanzada y con pérdida de cromosoma Y.
Pequeño pero relevante
El cromosoma Y es el más pequeño de todos nuestros cromosomas, también en el ratón. Pero contiene genes fundamentales. Por un lado, el SRY, que dirige el desarrollo del embrión hacia hombres, con las características sexuales y órganos sexuales masculinos. Por otro, genes que tienen que ver con el funcionamiento del sistema inmunitario.
Por eso su pérdida tiene consecuencias importantes, negativas, que llevarían a la fibrosis que acabaría causando la muerte en los hombres antes que en las mujeres.
Ahora ya sabemos por qué hay mas viudas que viudos.
La versión original de este artículo fue publicada en GenÉtica, el blog del autor en Naukas.![]()
Lluís Montoliu, Investigador científico del CSIC, Centro Nacional de Biotecnología (CNB - CSIC)
Este artículo fue publicado originalmente en The Conversation. Lea el original.
Apoya TU periodismo independiente y crítico
Ayúdanos a contribuir a la Defensa del Estado de Derecho Haz tu aportación